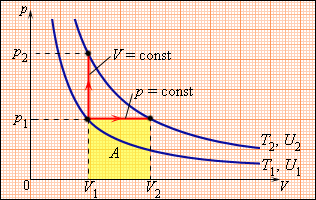
Теплоёмкость идеального газа
Удельная теплоемкость вещества —это количество теплоты, необходимое для нагревания единицы массы вещества на 1 К:. Молярная теплоемкость вещества — количество теплоты, необходимое для нагревания 1 моля вещества на 1 К:. Из сравнения этих формул находим связь между молярной и удельной теплоемкостями вещества. Поскольку количество теплоты является функцией процесса, то и теплоемкость является функцией процесса, т. В случае газов различают теплоемкости газа при постоянном объеме и постоянном давлении. Представим первое начало термодинамики для одного моля газа в виде.






В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q , то его температура и внутренняя энергия претерпевают изменения. Необходимое для нагревания 1 к г вещества на 1 К количество теплоты Q носит название удельной теплоемкости вещества c , а ее формула выглядит следующим образом:. В большом количестве ситуаций удобной для использования является молярная теплоемкость C :.




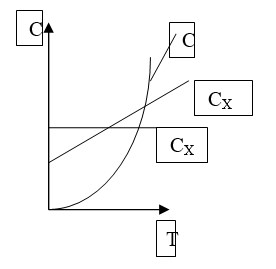



Теплоёмкость — количество теплоты , поглощаемой выделяемой телом в процессе нагревания остывания на 1 кельвин. Неоднозначность в определении теплоёмкости [10] на практике устраняют тем, что выбирают и фиксируют путь квазистатического процесса обычно оговаривается, что процесс происходит при постоянном давлении, равном атмосферному. При однозначном выборе процесса теплоёмкость становится параметром состояния [11] [12] и теплофизическим свойством вещества , образующего термодинамическую систему [13].